ფიზიკაში განმარტებების ცოდნა არის ძირითადი ფაქტორი სხვადასხვა ფიზიკური პრობლემების წარმატებით გადაჭრისთვის. სტატიაში განვიხილავთ რას ნიშნავს იზობარიული, იზოქორული, იზოთერმული და ადიაბატური პროცესები იდეალური გაზის სისტემისთვის.
იდეალური აირი და მისი განტოლება
იზობარული, იზოქორიული და იზოთერმული პროცესების აღწერამდე, განვიხილოთ რა არის იდეალური გაზი. ფიზიკაში ამ განმარტების თანახმად, ისინი განიხილავენ სისტემას, რომელიც შედგება უზარმაზარი რაოდენობის განზომილებიანი და არაურთიერთმოქცეული ნაწილაკებისგან, რომლებიც მოძრაობენ მაღალი სიჩქარით ყველა მიმართულებით. სინამდვილეში, ჩვენ ვსაუბრობთ მატერიის აირისებრ აგრეგატულ მდგომარეობაზე, რომელშიც ატომებსა და მოლეკულებს შორის მანძილი ბევრად აღემატება მათ ზომებს და რომელშიც ნაწილაკების ურთიერთქმედების პოტენციური ენერგია უგულებელყოფილია მისი სიმცირის გამო, კინეტიკურ ენერგიასთან შედარებით.
იდეალური აირის მდგომარეობა არის მისი თერმოდინამიკური პარამეტრების მთლიანობა. მთავარია ტემპერატურა, მოცულობა და წნევა. ავღნიშნოთ ისინი შესაბამისად T, V და P ასოებით. XIX საუკუნის 30-იან წლებშიკლაპეირონმა (ფრანგმა მეცნიერმა) პირველად დაწერა განტოლება, რომელიც აერთიანებს მითითებულ თერმოდინამიკურ პარამეტრებს ერთი თანასწორობის ფარგლებში. ასე გამოიყურება:
PV=nRT,
სადაც n და R არის ნივთიერებების რაოდენობა და აირის მუდმივი, შესაბამისად.
რა არის იზოპროცესები გაზებში?
როგორც ბევრმა შენიშნა, იზობარული, იზოქორული და იზოთერმული პროცესები თავიანთ სახელებში იყენებენ ერთსა და იმავე "iso" პრეფიქსს. ეს ნიშნავს ერთი თერმოდინამიკური პარამეტრის თანასწორობას მთელი პროცესის გავლისას, ხოლო დანარჩენი პარამეტრები იცვლება. მაგალითად, იზოთერმული პროცესი მიუთითებს, რომ შედეგად, სისტემის აბსოლუტური ტემპერატურა შენარჩუნებულია მუდმივი, ხოლო იზოქორული პროცესი მიუთითებს მუდმივ მოცულობაზე.
იზოპროცესები მოსახერხებელია შესასწავლად, ვინაიდან ერთ-ერთი თერმოდინამიკური პარამეტრის დაფიქსირება იწვევს აირის მდგომარეობის ზოგადი განტოლების გამარტივებას. მნიშვნელოვანია აღინიშნოს, რომ გაზის კანონები ყველა ამ იზოპროცესისთვის აღმოაჩინეს ექსპერიმენტულად. მათმა ანალიზმა საშუალება მისცა კლეპეირონს მიეღო შემცირებული უნივერსალური განტოლება.
იზობარული, იზოქორული და იზოთერმული პროცესები
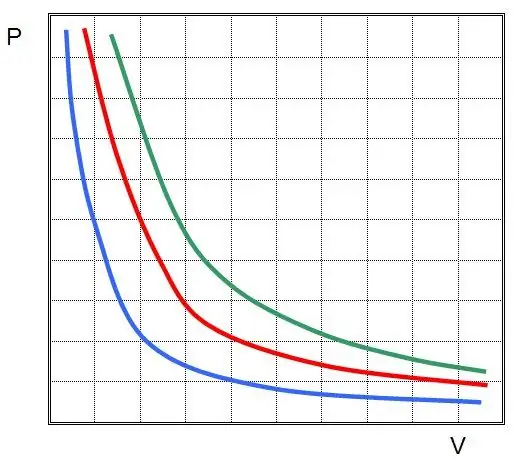
პირველი კანონი აღმოაჩინეს იდეალურ გაზში იზოთერმული პროცესისთვის. ახლა მას ბოილ-მარიოტის კანონს უწოდებენ. ვინაიდან T არ იცვლება, მდგომარეობის განტოლება გულისხმობს ტოლობას:
PV=კონსტ.
სხვა სიტყვებით რომ ვთქვათ, სისტემაში წნევის ნებისმიერი ცვლილება იწვევს მისი მოცულობის უკუპროპორციულ ცვლილებას, თუ გაზის ტემპერატურა მუდმივია. P(V) ფუნქციის გრაფიკი არისჰიპერბოლა.
იზობარული პროცესი - ეს არის სისტემის მდგომარეობის ცვლილება, რომელშიც წნევა მუდმივი რჩება. კლაპეირონის განტოლებაში P-ის მნიშვნელობის დაფიქსირების შემდეგ მივიღებთ შემდეგ კანონს:
V/T=კონსტ.
ეს თანასწორობა ატარებს ფრანგი ფიზიკოსის ჟაკ შარლის სახელს, რომელმაც იგი მიიღო მე-18 საუკუნის ბოლოს. იზობარი (V(T) ფუნქციის გრაფიკული გამოსახულება) სწორ ხაზს ჰგავს. რაც უფრო მეტი წნევა სისტემაში, მით უფრო სწრაფად იზრდება ეს ხაზი.
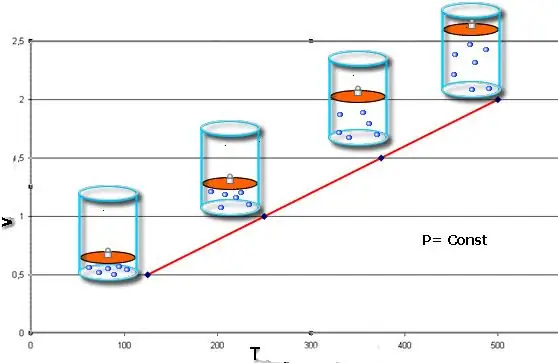
იზობარული პროცესის განხორციელება მარტივია, თუ გაზი თბება დგუშის ქვეშ. ამ უკანასკნელის მოლეკულები ზრდიან სიჩქარეს (კინეტიკურ ენერგიას), ქმნიან უფრო მაღალ წნევას დგუშზე, რაც იწვევს გაზის გაფართოებას და P.
-ის მუდმივ მნიშვნელობის შენარჩუნებას.
საბოლოოდ, მესამე იზოპროცესი არის იზოქორული. ის მუშაობს მუდმივი მოცულობით. მდგომარეობის განტოლებიდან ვიღებთ შესაბამის ტოლობას:
P/T=კონსტ.
ფიზიკოსებს შორის ცნობილია, როგორც გეი-ლუსაკის კანონი. პირდაპირი პროპორციულობა წნევასა და აბსოლუტურ ტემპერატურას შორის მიუთითებს იმაზე, რომ იზოქორული პროცესის გრაფიკი, ისევე როგორც იზობარის გრაფიკი, არის სწორი ხაზი დადებითი დახრილობით.
მნიშვნელოვანია გვესმოდეს, რომ ყველა იზოპროცესი ხდება დახურულ სისტემებში, ანუ n-ის მნიშვნელობა შენარჩუნებულია მათი მიმდინარეობისას.
ადიაბატური პროცესი
ეს პროცესი არ მიეკუთვნება "iso" კატეგორიას, რადგან სამივე თერმოდინამიკური პარამეტრი იცვლება მისი გავლისას. ადიაბატურიეწოდება გადასვლას სისტემის ორ მდგომარეობას შორის, რომელშიც ის არ ცვლის სითბოს გარემოსთან. ამრიგად, სისტემის გაფართოება ხორციელდება მისი შიდა ენერგიის რეზერვების გამო, რაც იწვევს მასში წნევის და აბსოლუტური ტემპერატურის მნიშვნელოვან ვარდნას.
ადიაბატური პროცესი იდეალური გაზისთვის აღწერილია პუასონის განტოლებებით. ერთ-ერთი მათგანი ნაჩვენებია ქვემოთ:
PVγ=კონსტ,
სადაც γ არის სითბოს სიმძლავრის თანაფარდობა მუდმივ წნევაზე და მუდმივ მოცულობაზე.
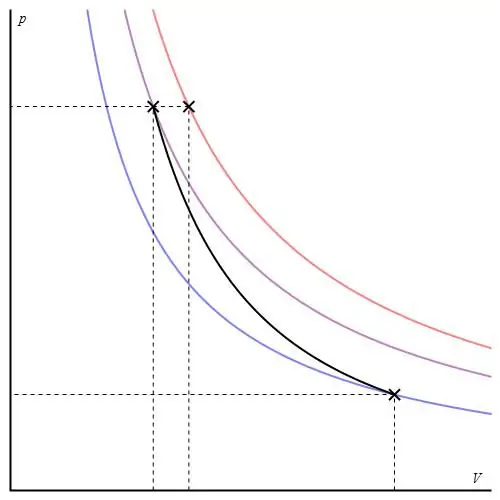
ადიაბატური გრაფიკი განსხვავდება იზოქორული პროცესის გრაფიკისგან და იზობარული გრაფიკისგან, მაგრამ ის ჰიპერბოლას (იზოთერმას) ჰგავს. P-V ღერძებში ადიაბატი უფრო მკვეთრად იქცევა ვიდრე იზოთერმი.






