გაზები, თერმოდინამიკის თვალსაზრისით, აღწერილია მაკროსკოპული მახასიათებლების სიმრავლით, რომელთაგან მთავარია ტემპერატურა, წნევა და მოცულობა. ერთ-ერთი ამ პარამეტრის მუდმივობა და მეორე ორის ცვლილება მიუთითებს იმაზე, რომ გაზში ხდება ერთი ან მეორე იზოპროცესი. ამ სტატიას მივუძღვნით დეტალურ პასუხს კითხვებზე, რომ ეს არის იზოქორული პროცესი, რით განსხვავდება ის იზოთერმული და იზობარიული ცვლილებებისგან გაზის სისტემის მდგომარეობებში.
იდეალური აირი ფიზიკაში

სანამ უპასუხეთ კითხვაზე, რომ ეს არის იზოქორული პროცესი, თქვენ უკეთ უნდა გაეცნოთ იდეალური გაზის კონცეფციას. ფიზიკაში იგულისხმება ნებისმიერი გაზი, რომელშიც მისი შემადგენელი ნაწილაკების საშუალო კინეტიკური ენერგია ბევრად აღემატება მათი ურთიერთქმედების პოტენციურ ენერგიას და ამ ნაწილაკებს შორის მანძილი რამდენიმე რიგით აღემატება მათ ხაზოვან ზომებს. აღნიშნულ პირობებში შესაძლებელია, განხორციელებისასგამოთვლები არ ითვალისწინებს ნაწილაკებს შორის ურთიერთქმედების ენერგიას (ის ტოლია ნულის), ასევე შეიძლება ვივარაუდოთ, რომ ნაწილაკები არის მატერიალური წერტილები, რომლებსაც აქვთ გარკვეული მასა m.
ერთადერთი პროცესი, რომელიც ხდება იდეალურ გაზში, არის ნაწილაკების შეჯახება ნივთიერების შემცველი ჭურჭლის კედლებთან. ეს შეჯახებები პრაქტიკაში ვლინდება, როგორც გარკვეული წნევის არსებობა გაზში P.
როგორც წესი, ნებისმიერი აირისებრი ნივთიერება, რომელიც შედგება შედარებით ქიმიურად ინერტული მოლეკულებისგან და რომელსაც აქვს დაბალი წნევა და მაღალი ტემპერატურა, შეიძლება ჩაითვალოს იდეალურ გაზად საკმარისი სიზუსტით პრაქტიკული გამოთვლებისთვის.
განტოლება, რომელიც აღწერს იდეალურ გაზს
რა თქმა უნდა, საუბარია კლაპეირონ-მენდელეევის უნივერსალურ კანონზე, რომელიც კარგად უნდა გავიგოთ, რათა გავიგოთ, რომ ეს არის იზოქორული პროცესი. ასე რომ, მდგომარეობის უნივერსალურ განტოლებას აქვს შემდეგი ფორმა:
PV=nRT.
ანუ P წნევის და გაზის მოცულობის V ნამრავლი ტოლია აბსოლუტური ტემპერატურის T ნამრავლისა და ნივთიერების ოდენობის n მოლში, სადაც R არის პროპორციულობის კოეფიციენტი. თავად განტოლება პირველად დაწერა ემილ კლაპეირონმა 1834 წელს, ხოლო XIX საუკუნის 70-იან წლებში დ. მენდელეევმა შეცვალა მასში ერთი უნივერსალური გაზის მუდმივი R (8.314 J/(molK) მუდმივი სიდიდეების ნაკრები.)).
კლაპეირონ-მენდელეევის განტოლების შესაბამისად, დახურულ სისტემაში გაზის ნაწილაკების რაოდენობა მუდმივი რჩება, ამიტომ არის მხოლოდ სამი მაკროსკოპული პარამეტრი, რომელიც შეიძლება შეიცვალოს (T, Pდა V). ეს უკანასკნელი ფაქტი ემყარება სხვადასხვა იზოპროცესების გაგებას, რომლებიც ქვემოთ იქნება განხილული.
რა არის იზოქორული პროცესი?
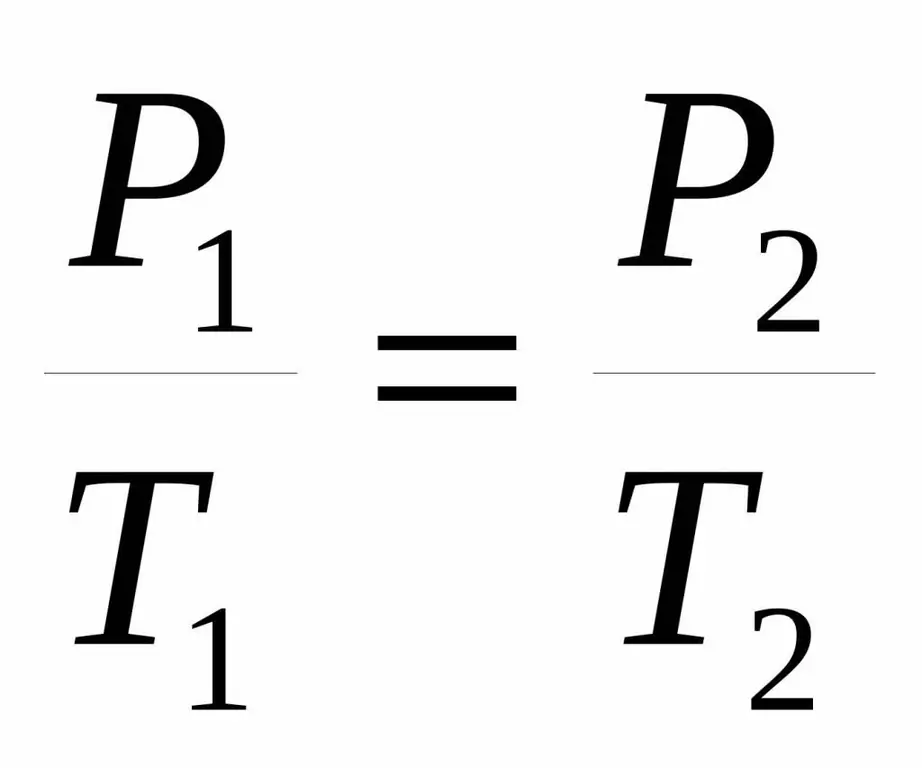
ეს პროცესი გაგებულია, როგორც სისტემის მდგომარეობის აბსოლუტურად ნებისმიერი ცვლილება, რომელშიც მისი მოცულობა შენარჩუნებულია.
თუ მივმართავთ მდგომარეობის უნივერსალურ განტოლებას, შეგვიძლია ვთქვათ, რომ იზოქორული პროცესის დროს გაზში იცვლება მხოლოდ წნევა და აბსოლუტური ტემპერატურა. იმის გასაგებად, თუ როგორ იცვლება თერმოდინამიკური პარამეტრები, ჩვენ ვწერთ შესაბამის მათემატიკურ გამოსახულებას:
P / T=კონსტ.
ზოგჯერ ეს ტოლობა მოცემულია ოდნავ განსხვავებული ფორმით:
P1 / T1=P2 / T 2.
ორივე თანასწორობას უწოდებენ ჩარლზის კანონს ფრანგი მეცნიერის სახელის მიხედვით, რომელმაც მე-18 საუკუნის ბოლოს ექსპერიმენტულად მიიღო აღნიშნული დამოკიდებულება.

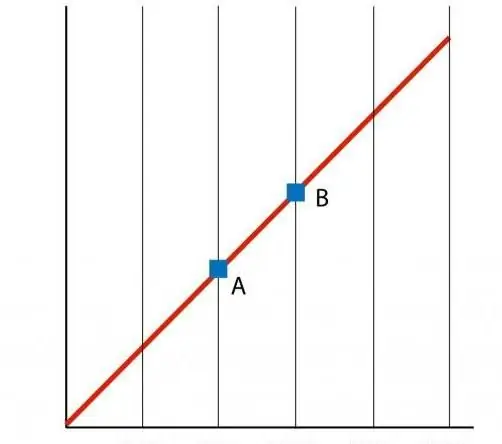
თუ ავაშენებთ P(T) ფუნქციის გრაფიკს, მაშინ მივიღებთ სწორხაზოვან დამოკიდებულებას, რომელსაც იზოქორი ეწოდება. ნებისმიერი იზოქორე (n და V-ის ყველა მნიშვნელობისთვის) არის სწორი ხაზი.
პროცესის ენერგეტიკული აღწერა
როგორც აღინიშნა, იზოქორული პროცესი არის სისტემის მდგომარეობის ცვლილება, რომელიც ხდება დახურულ, მაგრამ არა იზოლირებულ სისტემაში. საუბარია გაზსა და გარემოს შორის სითბოს გაცვლის შესაძლებლობაზე. ზოგადად, ნებისმიერი სითბოს Q მიწოდება სისტემაში იწვევს ორ შედეგს:
- ცვლის შინაგან ენერგიას U;
- გაზიმუშაობს A, გაფართოება ან შეკუმშვა.
ბოლო დასკვნა მათემატიკურად იწერება შემდეგნაირად:
Q=U + A.
იდეალური აირის იზოქორული პროცესი, მისი განმარტებით, არ გულისხმობს გაზის მიერ შესრულებულ სამუშაოს, რადგან მისი მოცულობა უცვლელი რჩება. ეს ნიშნავს, რომ სისტემას მიეწოდება მთელი სითბო მისი შიდა ენერგიის გასაზრდელად:
Q=U.
თუ ამ გამოსახულებაში ჩავანაცვლებთ შინაგანი ენერგიის გამოკვეთილ ფორმულას, მაშინ იზოქორული პროცესის სითბო შეიძლება წარმოდგენილი იყოს როგორც:
Q=z / 2nRT.
აქ z არის თავისუფლების გრადუსების რაოდენობა, რომელიც განისაზღვრება აირების შემადგენელი მოლეკულების პოლიატომური ბუნებით. ერთატომური გაზისთვის z=3, დიატომური აირისთვის - 5, ხოლო ტრიატომური და მეტისთვის - 6. აქ, თავისუფლების ხარისხებში, ვგულისხმობთ გადამყვან და ბრუნვის ხარისხებს.
თუ შევადარებთ გაზის სისტემის გათბობის ეფექტურობას იზოქორიულ და იზობარულ პროცესებში, მაშინ პირველ შემთხვევაში მივიღებთ მაქსიმალურ ეფექტურობას, ვინაიდან სისტემის მდგომარეობის იზობარული ცვლილების დროს გაზი ფართოვდება და სითბოს შეყვანის ნაწილი იხარჯება სამუშაოს შესრულებაზე.
იზობარული პროცესი
ზემოთ ჩვენ დეტალურად აღვწერეთ, რომ ეს არის იზოქორული პროცესი. ახლა მოდით ვთქვათ რამდენიმე სიტყვა სხვა იზოპროცესებზე. დავიწყოთ იზობარით. სახელწოდებიდან გამომდინარე, გაგებულია, როგორც სისტემის გადასვლა სახელმწიფოებს შორის მუდმივი წნევით. ეს პროცესი გეი-ლუსაკის კანონით აღწერილია შემდეგნაირად:
V / T=კონსტ.
როგორც იზოკორის შემთხვევაში, V(T) იზობარი ასევე წარმოადგენს სწორ ხაზს გრაფიკზე.
ამისთვისნებისმიერი იზობარული პროცესის დროს, მოსახერხებელია გაზის მიერ შესრულებული სამუშაოს გამოთვლა, რადგან ის უდრის მუდმივი წნევის ნამრავლს და მოცულობის ცვლილებას.
იზოთერმული პროცესი
ეს არის პროცესი, რომლის დროსაც სისტემის ტემპერატურა მუდმივი რჩება. იგი აღწერილია ბოილ-მარიოტის კანონით იდეალური გაზისთვის. საინტერესოა აღინიშნოს, რომ ეს არის პირველი ექსპერიმენტულად აღმოჩენილი გაზის კანონი (მე-17 საუკუნის მეორე ნახევარი). მისი მათემატიკური აღნიშვნა ასე გამოიყურება:
PV=კონსტ.
იზოქორული და იზოთერმული პროცესები განსხვავდება მათი გრაფიკული წარმოდგენის მიხედვით, ვინაიდან ფუნქცია P(V) არის ჰიპერბოლური და არა წრფივი ურთიერთობა.
პრობლემის გადაჭრის მაგალითი
მოდი გავაერთიანოთ სტატიაში მოყვანილი თეორიული ინფორმაცია მათი გამოყენებით პრაქტიკული პრობლემის გადასაჭრელად. ცნობილია, რომ სუფთა აირისებრი აზოტი ცილინდრში იყო 1 ატმოსფერო წნევის და 25 °C ტემპერატურის პირობებში. მას შემდეგ, რაც გაზის ბალონი გახურდა და მასში წნევა გაზომეს, აღმოჩნდა 1,5 ატმოსფერო. როგორია გაზის ტემპერატურა ცილინდრში გაცხელების შემდეგ? რა ოდენობით შეიცვალა გაზის შიდა ენერგია, თუ ბუშტში იყო 4 მოლი აზოტი.
პირველ კითხვაზე პასუხის გასაცემად ვიყენებთ შემდეგ გამოთქმას:
P1 / T1=P2 / T 2.
საიდან მივიღებთ:
T2=P2 / P1 T 1.
ამ გამოხატულებაში წნევა შეიძლება შეიცვალოს თვითნებურ ერთეულებშიგაზომვები, რადგან ისინი მცირდება და ტემპერატურა მხოლოდ კელვინებშია. ამის თქმით, ჩვენ ვიღებთ:
T2=1,5 /1298,15=447,224 კ.
გამოთვლილი ტემპერატურა გრადუს ცელსიუსში არის 174 °C.
რადგან აზოტის მოლეკულა არის დიატომური, მისი შინაგანი ენერგიის ცვლილება გაცხელების დროს შეიძლება განისაზღვროს შემდეგნაირად:
ΔU=5 / 2nRΔT.
ამ გამოსახულებაში ცნობილი მნიშვნელობების ჩანაცვლებით, ჩვენ მივიღებთ პასუხს ამოცანის მეორე კითხვაზე: ΔU=+12,4 კჯ.






