იდეალური აირის თვისებების შესწავლა მნიშვნელოვანი თემაა ფიზიკაში. გაზის სისტემების მახასიათებლების შესავალი იწყება ბოილ-მარიოტის განტოლების განხილვით, რადგან ეს არის იდეალური გაზის პირველი ექსპერიმენტულად აღმოჩენილი კანონი. უფრო დეტალურად განვიხილოთ სტატიაში.
რა იგულისხმება იდეალურ გაზში?
სანამ ბოილ-მარიოტის კანონსა და მის აღწერილ განტოლებაზე ვისაუბრებთ, განვსაზღვროთ იდეალური აირი. ჩვეულებრივ გაგებულია, როგორც თხევადი ნივთიერება, რომელშიც ნაწილაკები, რომლებიც მას ქმნიან, არ ურთიერთქმედებენ ერთმანეთთან და მათი ზომები უმნიშვნელოდ მცირეა ნაწილაკთაშორის საშუალო მანძილებთან შედარებით.
სინამდვილეში, ნებისმიერი გაზი რეალურია, ანუ მის შემადგენელ ატომებსა და მოლეკულებს აქვთ გარკვეული ზომა და არ ურთიერთქმედებენ ერთმანეთთან ვან დერ ვაალის ძალების დახმარებით. თუმცა, მაღალ აბსოლუტურ ტემპერატურაზე (300 K-ზე მეტი) და დაბალი წნევის დროს (ერთზე ნაკლები ატმოსფერო), ატომების და მოლეკულების კინეტიკური ენერგია ბევრად აღემატება ვან დერ ვაალის ურთიერთქმედების ენერგიას, ამიტომ რეალური გაზი მითითებულია.პირობები მაღალი სიზუსტით შეიძლება ჩაითვალოს იდეალურად.
ბოილ-მარიოტის განტოლება
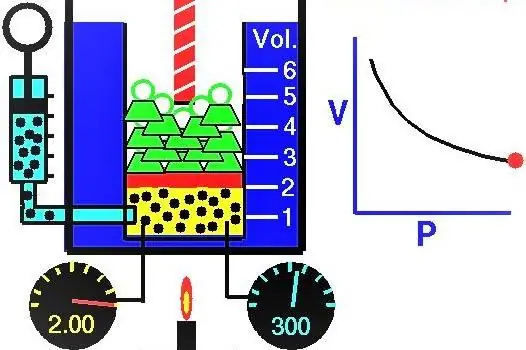
გაზების თვისებები ევროპელი მეცნიერები აქტიურად იკვლევდნენ XVII-XIX საუკუნეებში. პირველი გაზის კანონი, რომელიც აღმოაჩინეს ექსპერიმენტულად, იყო კანონი, რომელიც აღწერს გაზის სისტემის გაფართოებისა და შეკუმშვის იზოთერმული პროცესებს. შესაბამისი ექსპერიმენტები ჩაატარეს რობერტ ბოილმა 1662 წელს და ედმ მარიოტმა 1676 წელს. თითოეულმა ამ მეცნიერმა დამოუკიდებლად აჩვენა, რომ დახურულ გაზის სისტემაში იზოთერმული პროცესის დროს წნევა იცვლება მოცულობის საპირისპიროდ. პროცესის ექსპერიმენტულად მიღებული მათემატიკური გამოხატულება იწერება შემდეგი სახით:
PV=k
სადაც P და V არის წნევა სისტემაში და მისი მოცულობა, k არის გარკვეული მუდმივი, რომლის მნიშვნელობა დამოკიდებულია აირის ნივთიერების რაოდენობაზე და მის ტემპერატურაზე. თუ P(V) ფუნქციის დამოკიდებულებას ავაშენებთ გრაფიკზე, მაშინ ეს იქნება ჰიპერბოლა. ამ მოსახვევების მაგალითი ნაჩვენებია ქვემოთ.
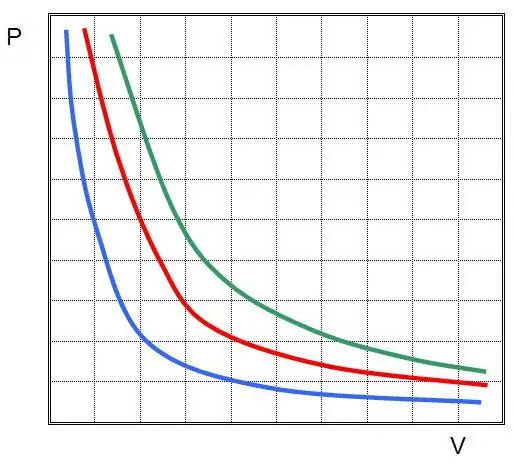
წერილობით ტოლობას ეწოდება ბოილ-მარიოტის განტოლება (კანონი). ეს კანონი შეიძლება მოკლედ ჩამოყალიბდეს შემდეგნაირად: იდეალური აირის გაფართოება მუდმივ ტემპერატურაზე იწვევს მასში წნევის პროპორციულ შემცირებას, პირიქით, გაზის სისტემის იზოთერმული შეკუმშვას თან ახლავს მასში წნევის პროპორციული მატება.
იდეალური აირის განტოლება
ბოილ-მარიოტის კანონი არის უფრო ზოგადი კანონის განსაკუთრებული შემთხვევა, რომელიც ატარებს მენდელეევის და სახელებს.კლაპეირონი. ემილ კლაპეირონმა, შეაჯამა ექსპერიმენტული ინფორმაცია გაზების ქცევის შესახებ სხვადასხვა გარე პირობებში, 1834 წელს მიიღო შემდეგი განტოლება:
PV=nRT
სხვა სიტყვებით რომ ვთქვათ, გაზის სისტემის V მოცულობის ნამრავლი და მასში P წნევა პირდაპირპროპორციულია T აბსოლუტური ტემპერატურის ნამრავლისა და n ნივთიერების რაოდენობაზე. ამ პროპორციულობის კოეფიციენტი აღინიშნება ასო R-ით და ეწოდება გაზის უნივერსალური მუდმივი. წერილობით განტოლებაში R-ის მნიშვნელობა გამოჩნდა რიგი მუდმივების ჩანაცვლების გამო, რომელიც გააკეთა დიმიტრი ივანოვიჩ მენდელეევმა 1874 წელს.
მდგომარეობის უნივერსალური განტოლებიდან მარტივია იმის დანახვა, რომ ტემპერატურის მუდმივობა და ნივთიერების რაოდენობა უზრუნველყოფს განტოლების მარჯვენა მხარის უცვლელობას, რაც ნიშნავს, რომ განტოლების მარცხენა მხარეც მუდმივი დარჩება.. ამ შემთხვევაში მივიღებთ ბოილ-მარიოტის განტოლებას.

სხვა გაზის კანონები
ზემოთ აბზაცში დაწერილი კლაპეირონ-მენდელეევის განტოლება შეიცავს სამ თერმოდინამიკურ პარამეტრს: P, V და T. თუ თითოეული მათგანი დაფიქსირდა და დანარჩენ ორს შეეცვალა, მაშინ მივიღებთ ბოილ-მარიოტს, ჩარლზის და გეი-ლუსაკის განტოლებები. ჩარლზის კანონი საუბრობს იზობარული პროცესის მოცულობასა და ტემპერატურას შორის პირდაპირ პროპორციულობაზე, ხოლო გეი-ლუსაკის კანონი ამბობს, რომ იზოქორული გადასვლის შემთხვევაში, გაზის წნევა იზრდება ან მცირდება აბსოლუტური ტემპერატურის პირდაპირპროპორციულად. შესაბამისი განტოლებები ასე გამოიყურება:
V/T=const როდესაც P=const;
P/T=const როდესაც V=const.
ასე რომამრიგად, ბოილ-მარიოტის კანონი გაზის სამი ძირითადი კანონიდან ერთ-ერთია. თუმცა, იგი განსხვავდება დანარჩენისგან გრაფიკული დამოკიდებულებით: ფუნქციები V(T) და P(T) სწორი ხაზებია, ფუნქცია P(V) არის ჰიპერბოლა.
ბოილ-მარიოტის კანონის გამოყენების დავალების მაგალითი
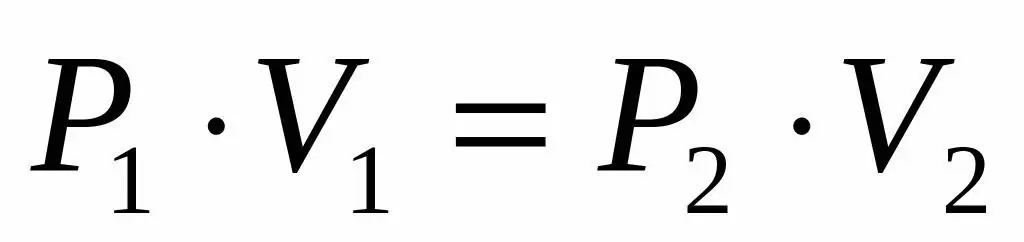
საწყის მდგომარეობაში დგუშის ქვეშ მყოფი გაზის მოცულობა იყო 2 ლიტრი, ხოლო წნევა 1 ატმოსფერო. როგორი იყო გაზის წნევა დგუშის აწევის შემდეგ და გაზის სისტემის მოცულობა გაიზარდა 0,5 ლიტრით. პროცესი განიხილება იზოთერმული.
რადგან ჩვენ მოცემულია იდეალური გაზის წნევა და მოცულობა და ასევე ვიცით, რომ ტემპერატურა უცვლელი რჩება მისი გაფართოების დროს, შეგვიძლია გამოვიყენოთ ბოილ-მარიოტის განტოლება შემდეგი სახით:
P1V1=P2V 2
ეს ტოლობა ამბობს, რომ მოცულობითი წნევის პროდუქტი მუდმივია გაზის ყველა მდგომარეობისთვის მოცემულ ტემპერატურაზე. გამოვსახავთ მნიშვნელობას P2 ტოლობიდან, მივიღებთ საბოლოო ფორმულას:
P2=P1V1/V 2
ზეწოლის გამოთვლებისას, ამ შემთხვევაში შეგიძლიათ გამოიყენოთ სისტემის გარეთ არსებული ერთეულები, რადგან ლიტრი იკუმშება და ვიღებთ წნევას P2 ატმოსფეროში. პირობის მონაცემების ჩანაცვლებით, მივდივართ პრობლემის კითხვაზე პასუხამდე: P2=0.8 ატმოსფერო.






